学习目标
1.知道难溶电解质的沉淀溶解平衡及其影响因素,能多角度、动态地分析难溶电解质的溶解 平衡。
2.知道溶度积的意义,建立根据溶度积和离子积的大小关系判断反应进行方向的思维模型。
3.能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。
4.学会用沉淀溶解平衡的移动解决生产、生活中的实际问题,并设计实验探究方案,进行沉 淀转化等实验探究
知识导学
知识点 1 难溶电解质的沉淀溶解平衡
1.25 ℃时,溶解性与溶解度的关系

2.难溶电解质的沉淀溶解平衡
(1)沉淀溶解平衡的建立
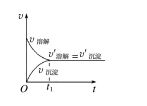
(2)沉淀溶解平衡方程式 以 AgCl 沉淀溶解平衡为例:AgCl(s) 溶解 沉淀 Ag+ (aq)+Cl- (aq)
特别提醒 沉淀溶解平衡方程式各物质要标明聚集状态。
(3)沉淀、溶解之间这种动态平衡也决定了 Ag+与 Cl-的反应不能完全进行到底。一般情况下, 当溶液中剩余离子的浓度小于 1×10-5 mol·L -1时,化学上通常认为生成沉淀的反应进行完 全了
3.难溶电解质沉淀溶解平衡的影响因素
(1)内因(决定因素):难溶电解质本身的性质。
(2)外因:温度、浓度等条件的影响符合勒夏特列原理。
(3)实例分析
已知沉淀溶解平衡:Mg(OH)2(s) Mg 2+ (aq)+2OH - (aq),请分析当改变下列条件时,对该 沉淀溶解平衡的影响,填写下表(浓度变化均指平衡后和原平衡比较)
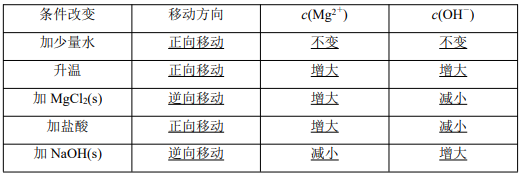
特别提醒 大多数电解质溶解度随温度的升高而增大,但有许多例外,如 Ca(OH)2,温度越 高,溶解度越小。
例 1.把 Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca 2+ (aq)+2OH - (aq)。 下列说法正确的是( )
A.恒温下向溶液中加入 CaO,溶液的 pH 升高
B.给溶液加热,溶液的 pH 升高
C.向溶液中加入 Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量 NaOH
难溶电解质沉淀溶解平衡与其电离平衡的区别
难溶电解质沉淀溶解平衡表示已溶溶质的离子与未溶溶质之间的平衡,是可逆过程,表达式 需要注明状态,如 Al(OH)3(s) Al3+ (aq)+3OH - (aq)。电离平衡是溶解的弱电解质分子 与离子之间的转化达到的平衡状态,难溶强电解质的电离,没有电离平衡,如 BaSO4===Ba 2 ++SO2- 4 ;难溶弱电解质的电离,存在电离平衡,如 Al(OH)3 Al3++3OH -。
知识点 2 溶度积常数
1.概念 难溶电解质的沉淀溶解平衡常数称为溶度积常数,简称溶度积,符号为 Ksp,Ksp的大小反映 难溶电解质在水中的溶解能力。
2.表达式
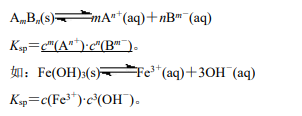
3.影响因素
溶度积 Ksp值的大小只与难溶电解质本身的性质和温度有关。
4.应用
定量判断给定条件下有无沉淀生成。

例 1.已知 25 ℃时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。
(1)25 ℃时,氯化银的饱和溶液中,c(Cl- )= ,向其中加入 NaCl 固体,溶解平 衡 ,溶度积常数 。
(2)25 ℃时,若向 50 mL 0.018 mol·L -1的 AgNO3溶液中加入 50 mL 0.020 mol·L -1的盐酸,混 合后溶液中的 c(Ag+ )= ,pH= 。
(3)25 ℃时,氯化银的饱和溶液和铬酸银的饱和溶液中,Ag+浓度大小顺序为 , 由此可得出 更难溶。
(4)25 ℃时,取一定量含有 I-、Cl-的溶液,向其中滴加 AgNO3 溶液,当 AgCl 和 AgI 同时 沉淀时,溶液中 cI- cCl- = 。
(5)将等体积的 4×10 - 3 mol·L - 1 的 AgNO3 溶液和 4×10 - 3 mol·L - 1 的 K2CrO4 溶液混合 (填“有”或“没有”)Ag2CrO4沉淀产生
归纳总结

知识点 3 沉淀的生成和溶解
1.沉淀的生成
(1)沉淀生成的应用 在无机物的制备和提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目 的。
(2)沉淀的方法

特别提醒 ①一般来说,当溶液中有多种可以沉淀的离子且生成相同类型的沉淀时,越难溶 (Ksp越小)的越先沉淀。 ②当离子浓度小于 1×10-5 mol·L -1时,认为已完全
2.沉淀的溶解
(1)沉淀溶解的原理 根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的相应离 子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
(2)实验探究:Mg(OH)2沉淀溶解
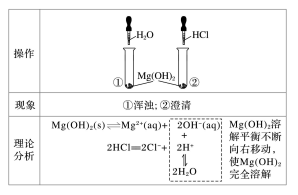
(3)沉淀溶解的方法
①酸溶解法:用强酸溶解的难溶电解质有 CaCO3、FeS、Al(OH)3、Ca(OH)2等。 如 CaCO3 难溶于水,却易溶于盐酸,原因是:CaCO3 在水中存在沉淀溶解平衡为 CaCO3(s) Ca 2+ (aq)+CO2- 3 (aq),当加入盐酸后发生反应:CO2- 3 +2H +===H2O+CO2↑, c(CO2- 3 )降低,溶液中 CO 2- 3 与 Ca 2+的离子积 Q(CaCO3)<Ksp(CaCO3),沉淀溶解平衡向溶解 方向移动。
②盐溶液溶解法:Mg(OH)2 难溶于水,能溶于盐酸、NH4Cl 溶液中。溶于 NH4Cl 溶液反应 的离子方程式为 Mg(OH)2+2NH + 4 ===Mg 2++2NH3·H2O。
例 1.当氢氧化镁固体在水中达到沉淀溶解平衡 Mg(OH)2(s) Mg 2+ (aq)+2OH - (aq)时, 为使 Mg(OH)2固体的量减少,需加入少量的( )
A.NH4NO3 B.NaOH C.MgSO4 D.Na2SO4
例 2.已知 Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶 液中含有 Cl-、Br-和 CrO 2- 4 的浓度均为 0.010 mol·L -1,向该溶液中逐滴加入 0.010 mol·L -1 的 AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO2- 4
B.CrO2- 4 、Br-、Cl-
C.Br-、Cl-、CrO2- 4
D.Br-、CrO2- 4 、Cl-
沉淀溶解常用的方法
(1)酸溶解法:如 CaCO3溶于盐酸,Al(OH)3、Cu(OH)2溶于强酸等。
(2)盐溶解法:如 Mg(OH)2可溶于 NH4Cl 溶液中。
(3)生成配合物法:如 AgCl 可溶于氨水。
(4)氧化还原法:如 CuS、HgS 等可溶于 HNO3中。
知识点 4 沉淀的转化
1.沉淀转化的过程探究
(1)实验探究 AgCl、AgI、Ag2S 的转化
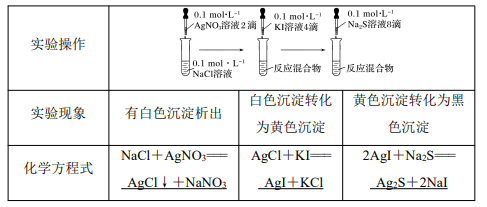
实验结论:AgCl 沉淀转化为 AgI 沉淀,AgI 沉淀又转化为 Ag2S 沉淀,说明溶解度由小到大 的顺序为

(2)实验探究 Mg(OH)2与 Fe(OH)3的转化
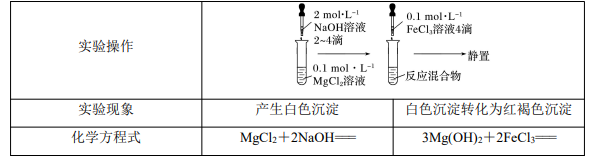
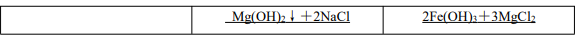
实验结论:Mg(OH)2沉淀转化为 Fe(OH)3沉淀,说明溶解度:Fe(OH)3
2.沉淀转化的实质与条件
(1)实质:沉淀的转化是指由一种难溶物转化为另一种难溶物的过程,其实质是沉淀溶解平 衡的移动。
(2)条件:两种沉淀的溶解度不同,溶解度小的沉淀可以转化为溶解度更小的沉淀,两者溶 解度相差越大转化越容易。
3.沉淀转化的应用
(1)锅炉除水垢(含有 CaSO4):CaSO4(s)―――――→ Na2CO3溶液 CaCO3(s)―――――→ 加酸如盐酸 Ca 2+ (aq),反应为 CaSO4+Na2CO3===CaCO3+Na2SO4,CaCO3+2HCl===CaCl2+H2O+CO2↑。
(2) 自 然 界 中 矿 物 的 转 化 : 原 生 铜 的 硫 化 物 ――――→ 氧化、淋滤 CuSO4 溶 液 ――――――――――――――→ 渗透、遇闪锌矿ZnS和方铅矿PbS 铜蓝(CuS),反应为 CuSO4+ZnS===CuS+ZnSO4,CuSO4+ PbS===CuS+PbSO4。
(3)工业废水处理 工业废水处理过程中,重金属离子可利用沉淀转化原理用 FeS 等难溶物转化为 HgS、Ag2S、 PbS 等沉淀。 用 FeS 除去 Hg 2+的离子方程式:FeS(s)+Hg 2+ (aq) HgS(s)+Fe 2+ (aq)。
